본 노트의 내용은
2017년 9월 3일 건국대 법학관 101호 대강의실에서 진행된
제9회 특별한 뇌과학 제 1강 (시냅스와 기억)의 내용을 녹취한 것입니다.
신경세포 시냅스 말단에서 일어나는 분자적 기전을 바탕으로 기억과 치매를 살펴본 이번 강의의 소주제별 내용입니다.
1. 핵심 키워드 : Activity dependence, NMDA & AMPA channel
2. 신경세포 수상돌기 말단의 막 채널 생성
3. 세포 내 칼슘농도 변화에 따른 spine 형태 변화
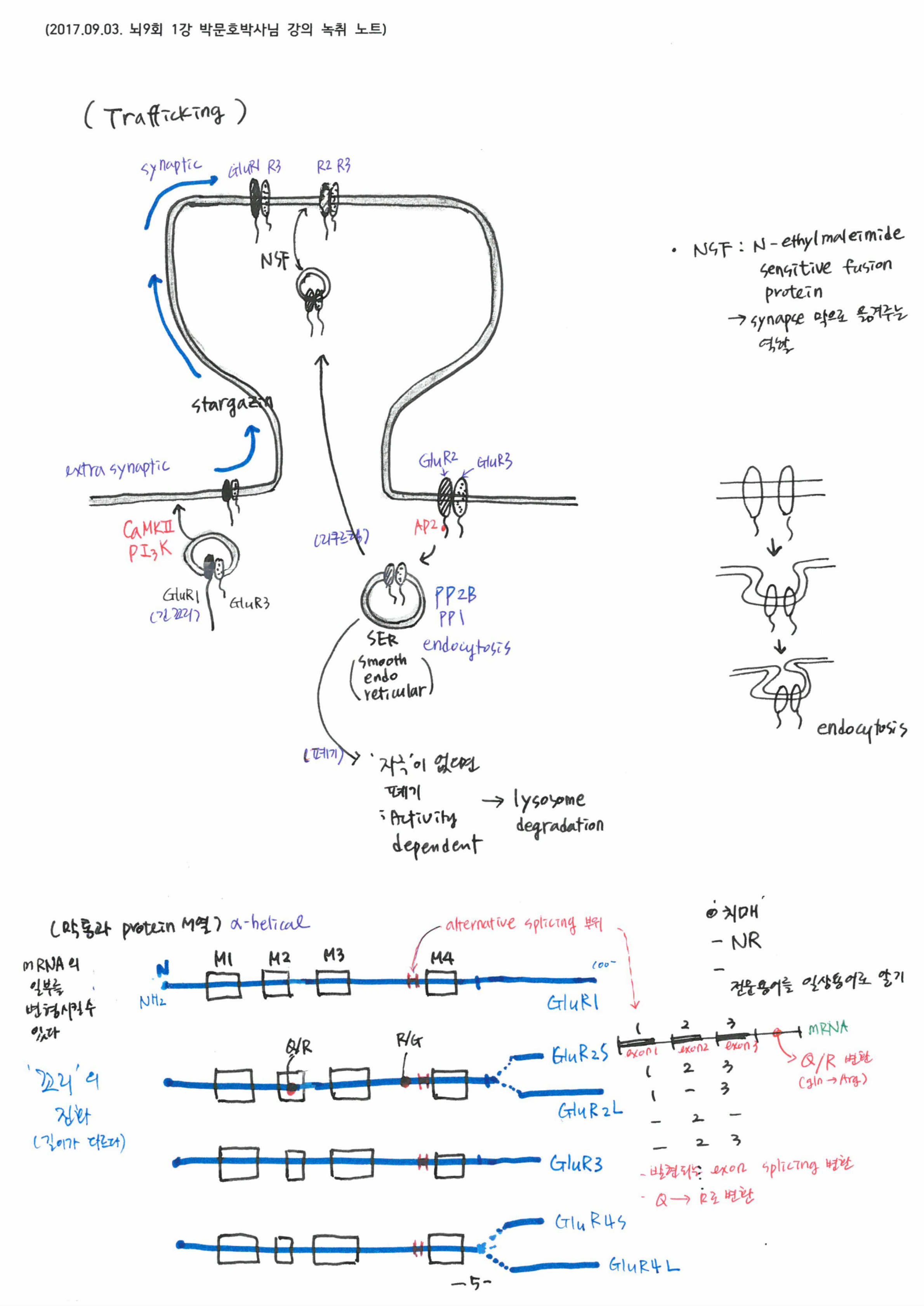
4. Protein trafficking, 막 채널 subunit 종류 및 다양성
5. 생체 조건별 spine 및 막 채널 subunit 구성비 변화
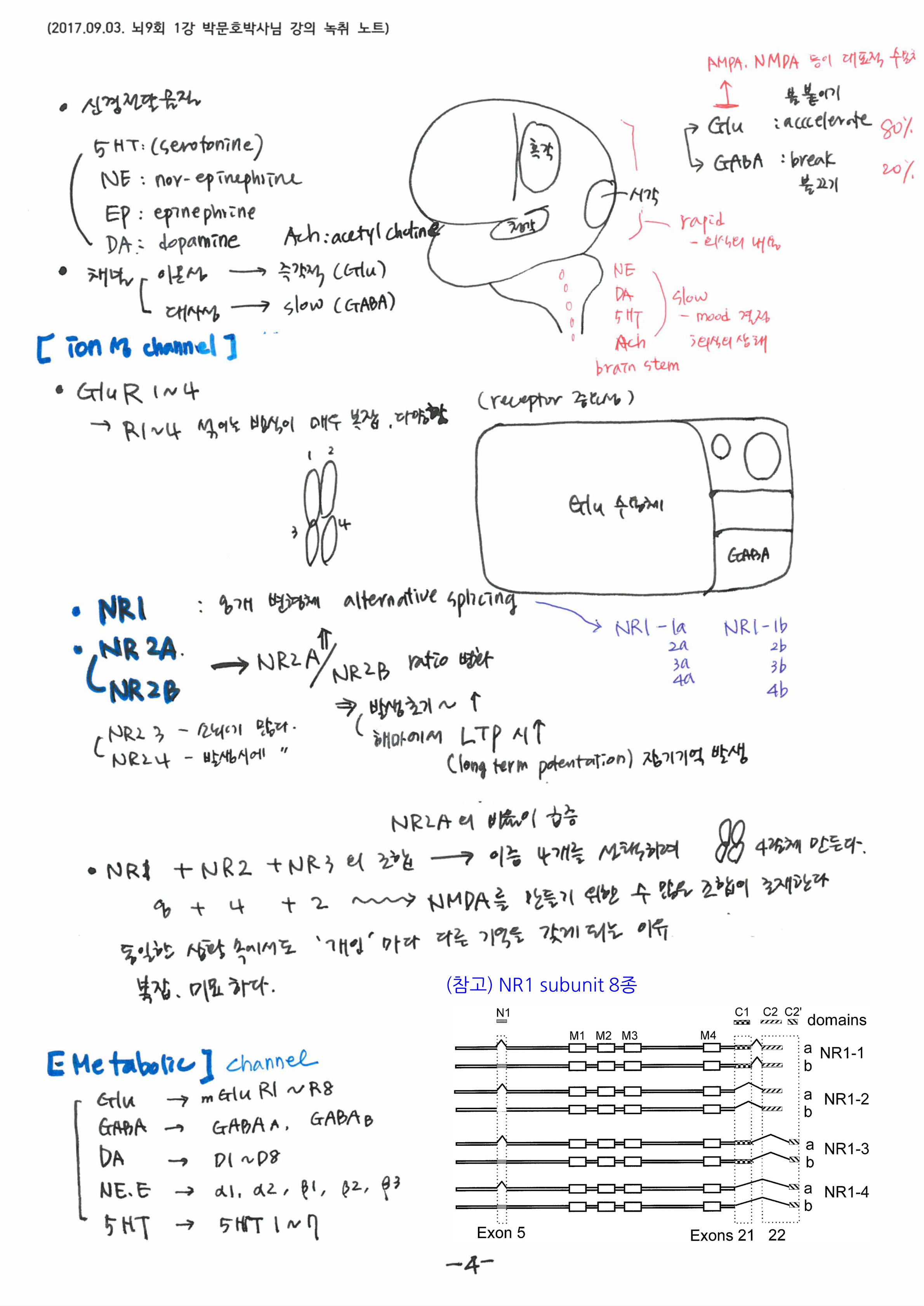
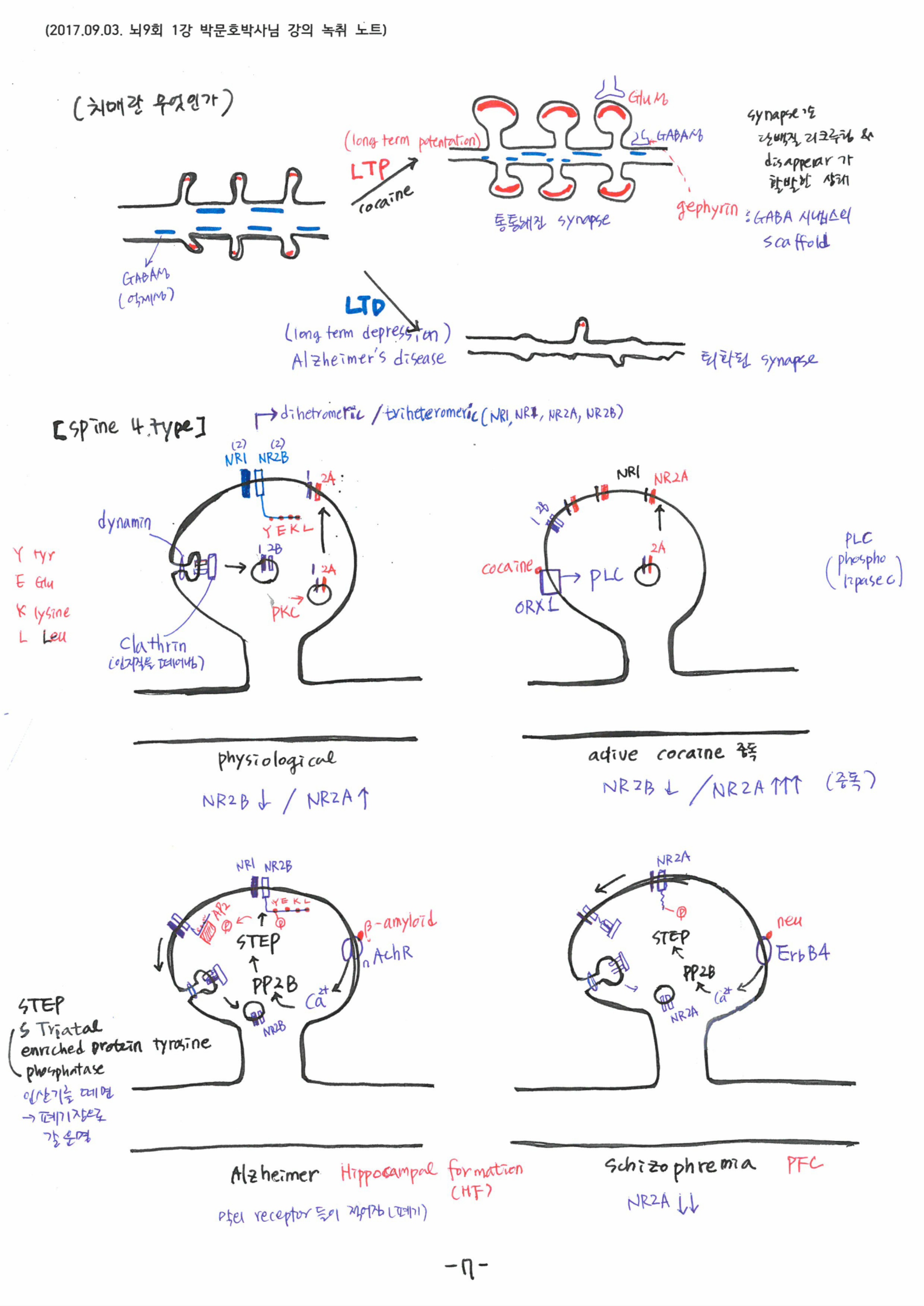
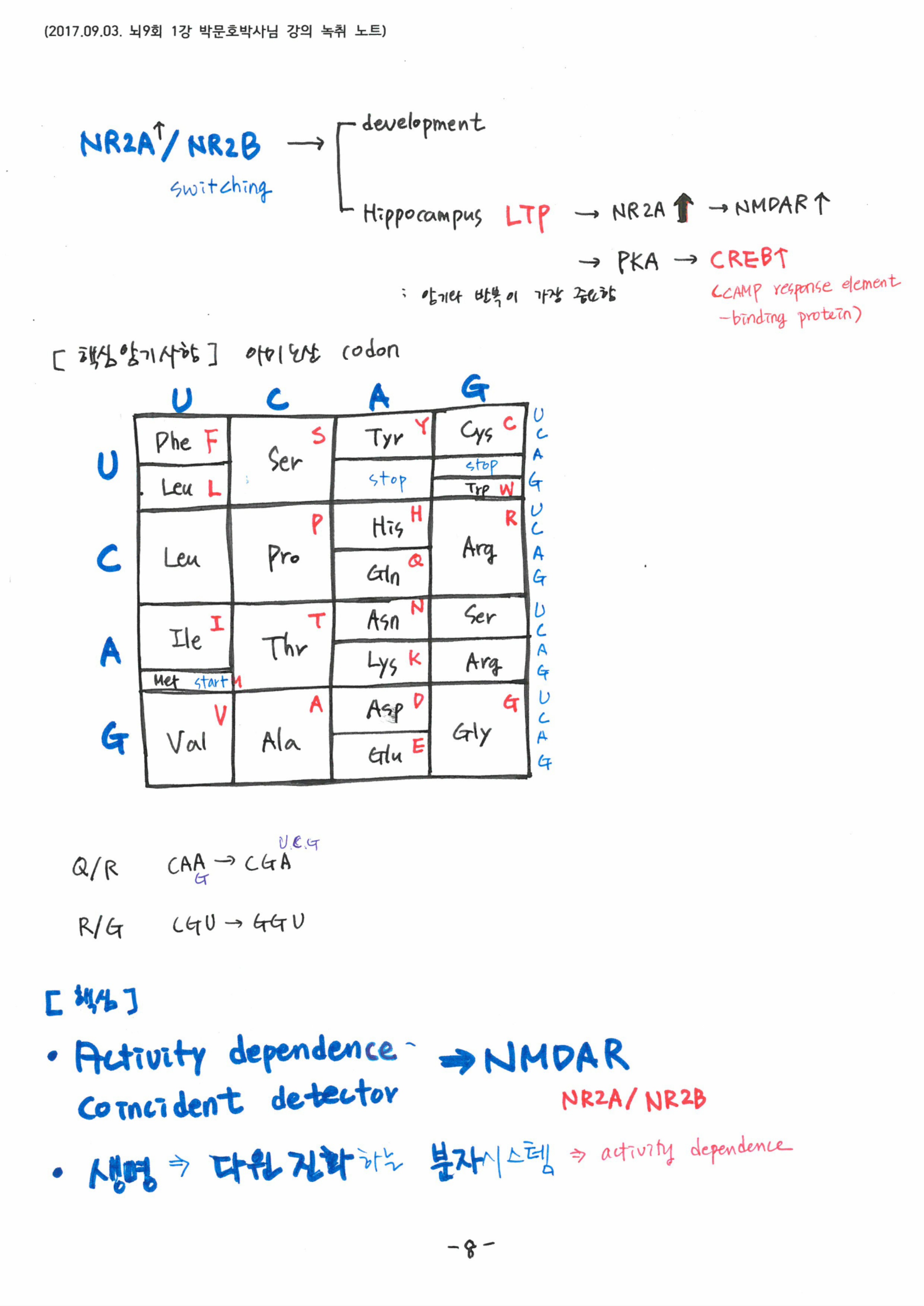
기억에서 가장 중요한 키워드는 Activity dependence와 coincidence detector로, 생명은 ‘다윈 진화’를 따르는 분자적 시스템임을 강조해 주셨습니다. 신경세포 수상돌기에서 이온채널이 만들어지고 막에 삽입되는 과정과, 세포내 칼슘농도 변화에 따른 세포 내 단백질과 이온채널간의 상호 작용기전을 단계별로 설명해 주셨습니다. 시냅스 말단에서 NMDA subunit인 NR2A/NR2B의 비율 증가가 해마의 장기기억과 밀접하게 연결되어 있다는 최근 이론도 소개해 주셨고, 결국 기억, 치매, 조현병이 모두 같은 현상이라는 설명도 덧붙이셨습니다.
주요 단백질의 명칭은 꼭 암기하라고 당부하셨고, 아미노산을 결정하는 RNA 코돈과 아미노산의 약자도 꼭 기억해 두라고 하셨습니다.
무엇보다 실제로 직접 적어보고, 반복해서 그려보는 것이 가장 빠른 학습법이라는 ‘핵심 tip’ 꼭 챙기시기 바랍니다.
첨부 : 특별한 뇌과학-제1강. 시냅스와 기억



박사님 강의를 듣고 느낀 점입니다. 정리해 주신 노트에 감사 드립니다.
생명 30억년의 역사는 세포의 능동적 작용입니다. 진핵세포가 다세포가 되면서 세포와 세포의 소통이필요하게 됩니다. 특히 외부 자극에 대한 조건에 충족하기 위해 외부 자극 중에 생명체에 필요한 것과 그렇지 않은 것을 구분해야했지요. 이것을 일종의 기억으로 보아야 합니다. 기억은 가상의 세계가 아닙니다.분명한 실체를 갖습니다. 세포의 이야기이니 분명 단백질 현상입니다.
신경세포는 단연코 활성전위를 만드는 세포입니다. 활성전위로 다른 신경세포와 소통합니다. 이 활성전위를만드는 장치는 이온에 의합니다. 이온이 전기를 띈 분자이기에 이온의 농도는 막에 의해 압력차를 형성하지요. 결국 전압차가 형성됩니다. 신경세포는 이온을 어떻게 받아 들일 것인가 혹은 세포 농도를 어떻게 유지 할것인가의 기로에 서게 됩니다. 소디움, 포타슘의 대변되는 전해질은 신장의 허락을 받습니다. 신경세포가 전해질을 원한것이 아니라 신장이 허락한 전해질의 농도로 신경세포는 전기를 만들어 냅니다.
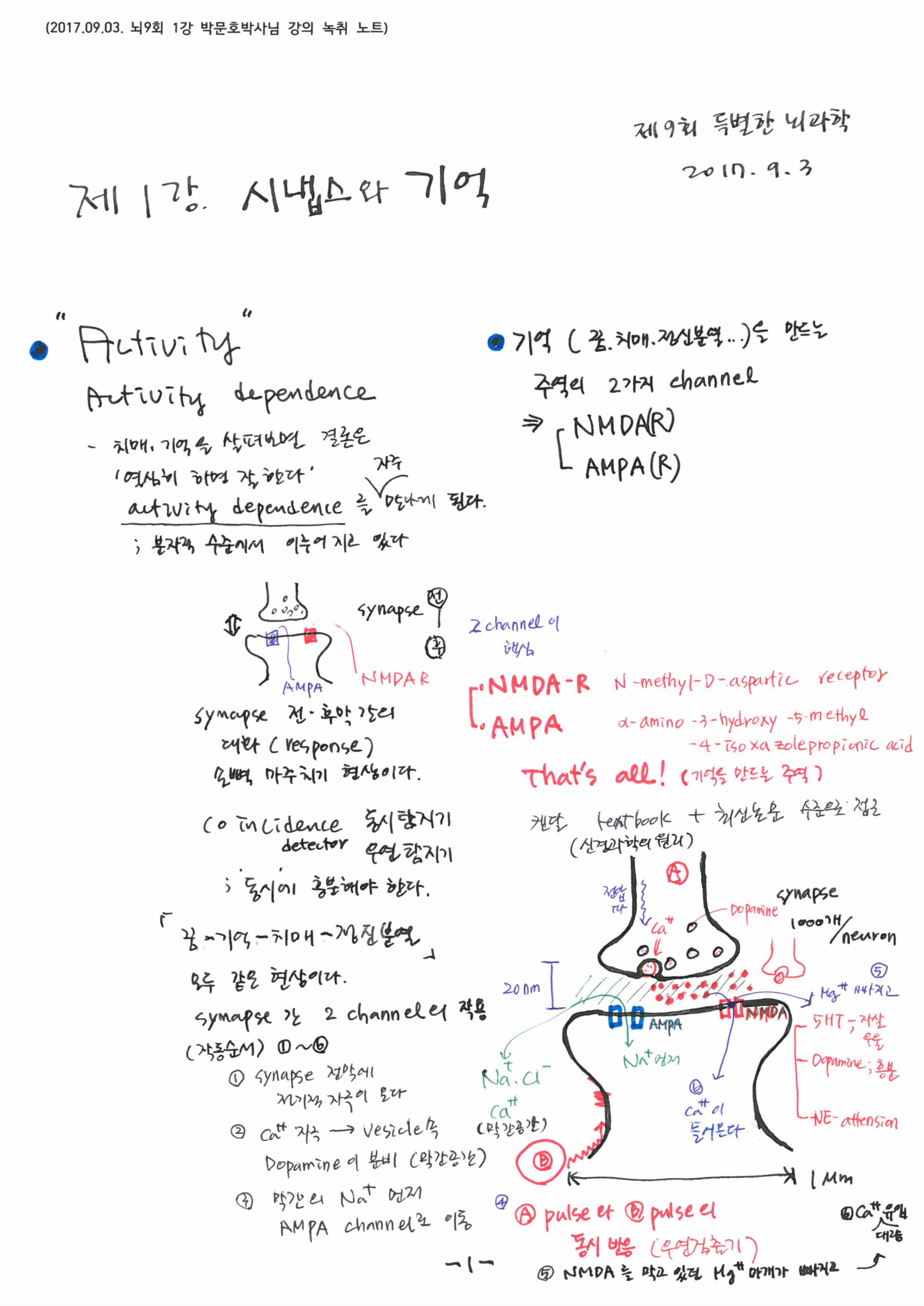
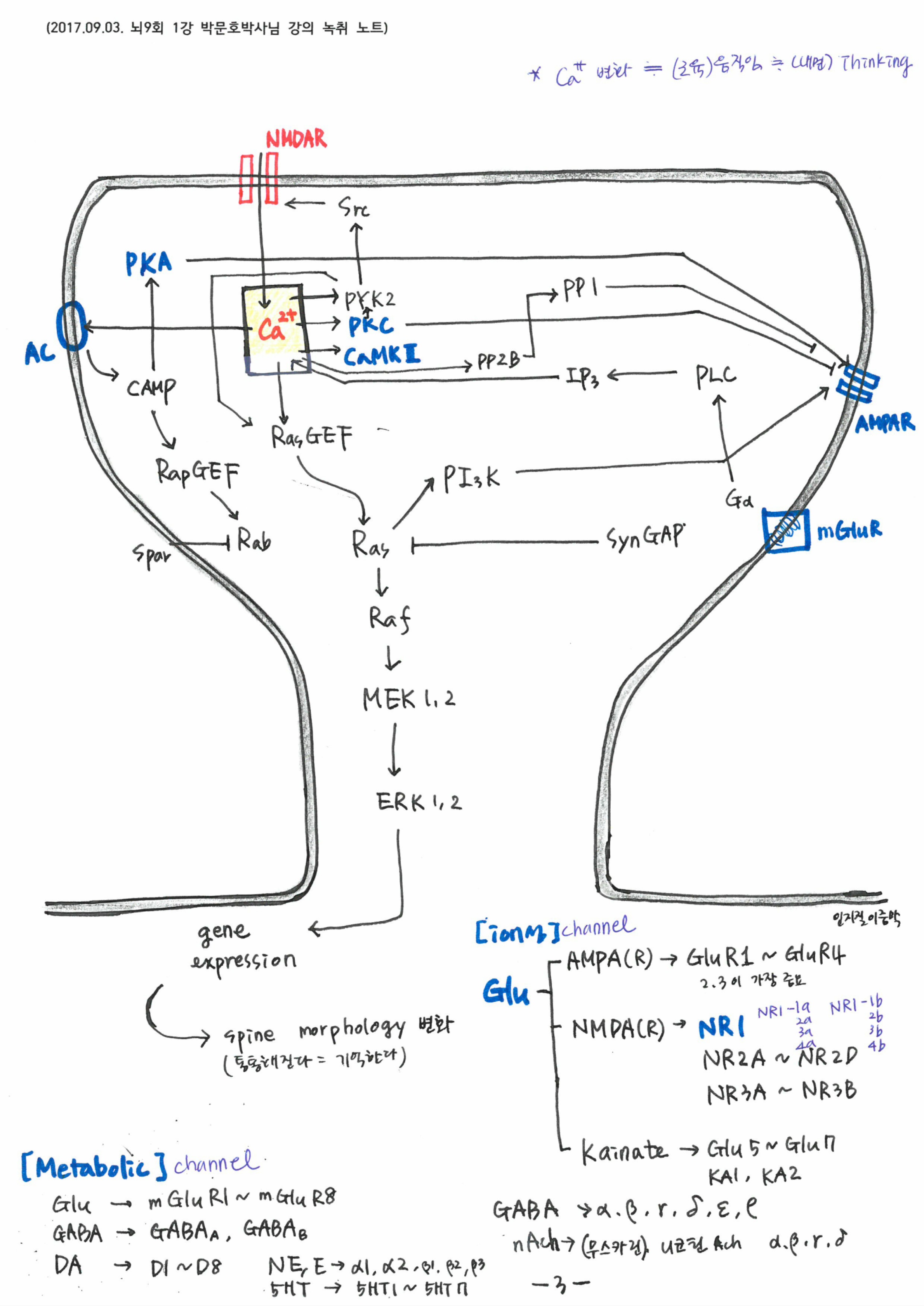
신경세포끼리의 대화는 결국 전기를 만드는 이온의 채널을 더 만드느냐 아니냐로 결정됩니다. AMPA, NMDA로 대표되는 이온 채널은 결국 신경세포의 전기 신호를 결정합니다. 전기신호는 기억의 또 다른 모습이며, 전기를 만드는 실체는 이온채널입니다. 세포의 진화는 단백질을 통해 이온 채널을 바꾸는데 있습니다. 이를 가능하게 한 것이 칼슙입니다. 로돌프 이나스가 칼슘과 이온의 위험한 정사라고 표현할 정도로 세포에서 칼슘은 위험합니다. 칼슙을 붙들지 않으면 세포는 그대로 굳어 뼈가 됩니다. 이를 붙잡는 노력이 결국 AMPA 수용기를만들어 냅니다. Na 이온의 유입은 활동전위를 증가 시킵니다. 칼슘의 유입은 전기 신호에 의하고 칼슘은 칼슘을 붙들어 매는 여러 장치에 의해 이온 채널을 만듭니다. 신경세포는 전기를 만드는 장치이고, 전기는 이온에 의해 만들어지기 때문에 칼슘이 전기적 신호를 만드는 꼴이 됩니다. 일종의 기억의 생성입니다.
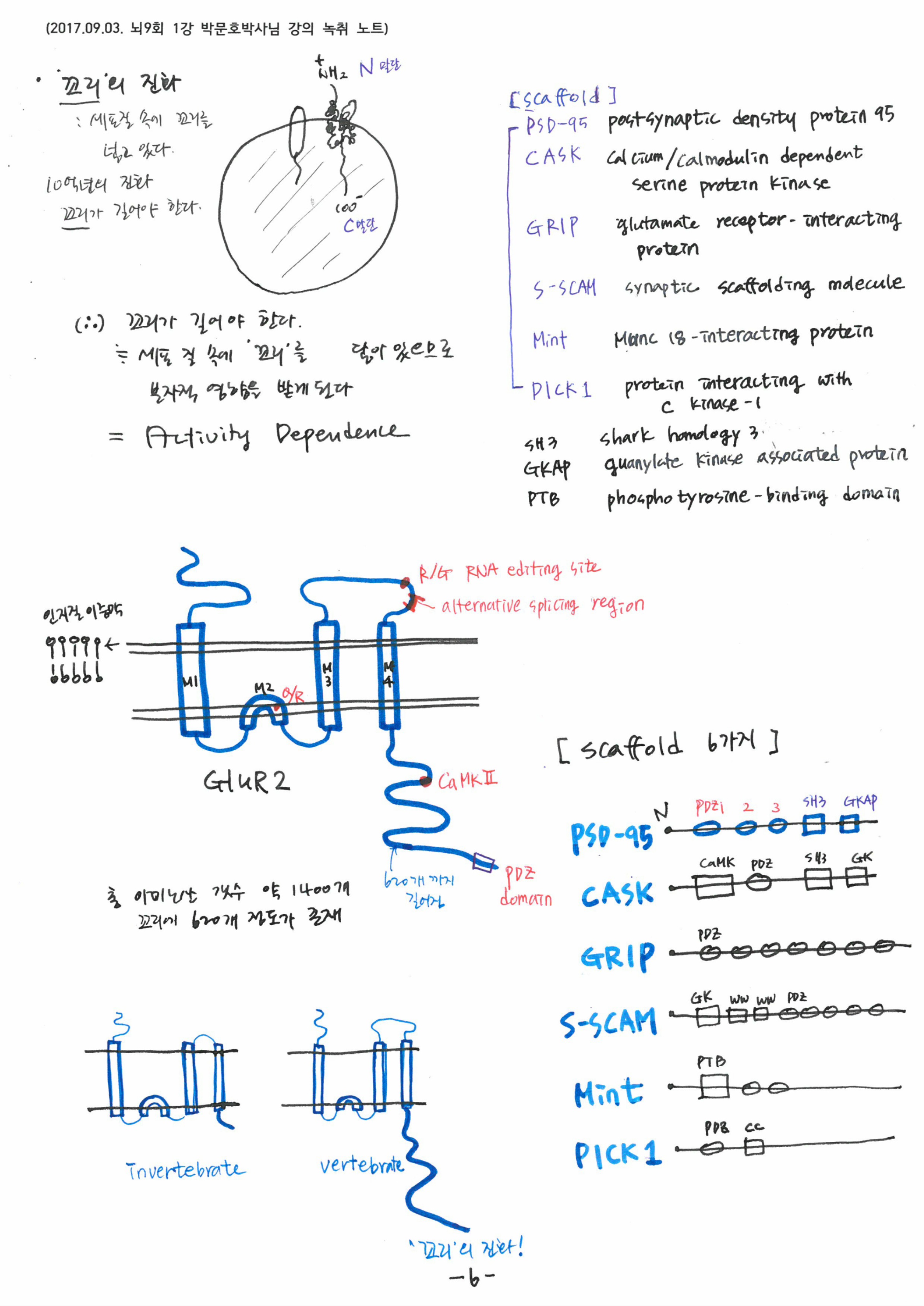
신경세포에서 이온 채널이 작동하기 위해서는 시냅스를 이용합니다. 오토랑케에 의해 발견된 시냅스는 신경전달물질의 이동을 가능하게 합니다. 그러나 이것 또한 실체를 필요로 합니다. 세포의 골격을 통해 어떤 모양을 만들지 못하면 신경세포는 반응하지 않지요; 여기에 PSD95와 같은 단백질 결합이 필요합니다.
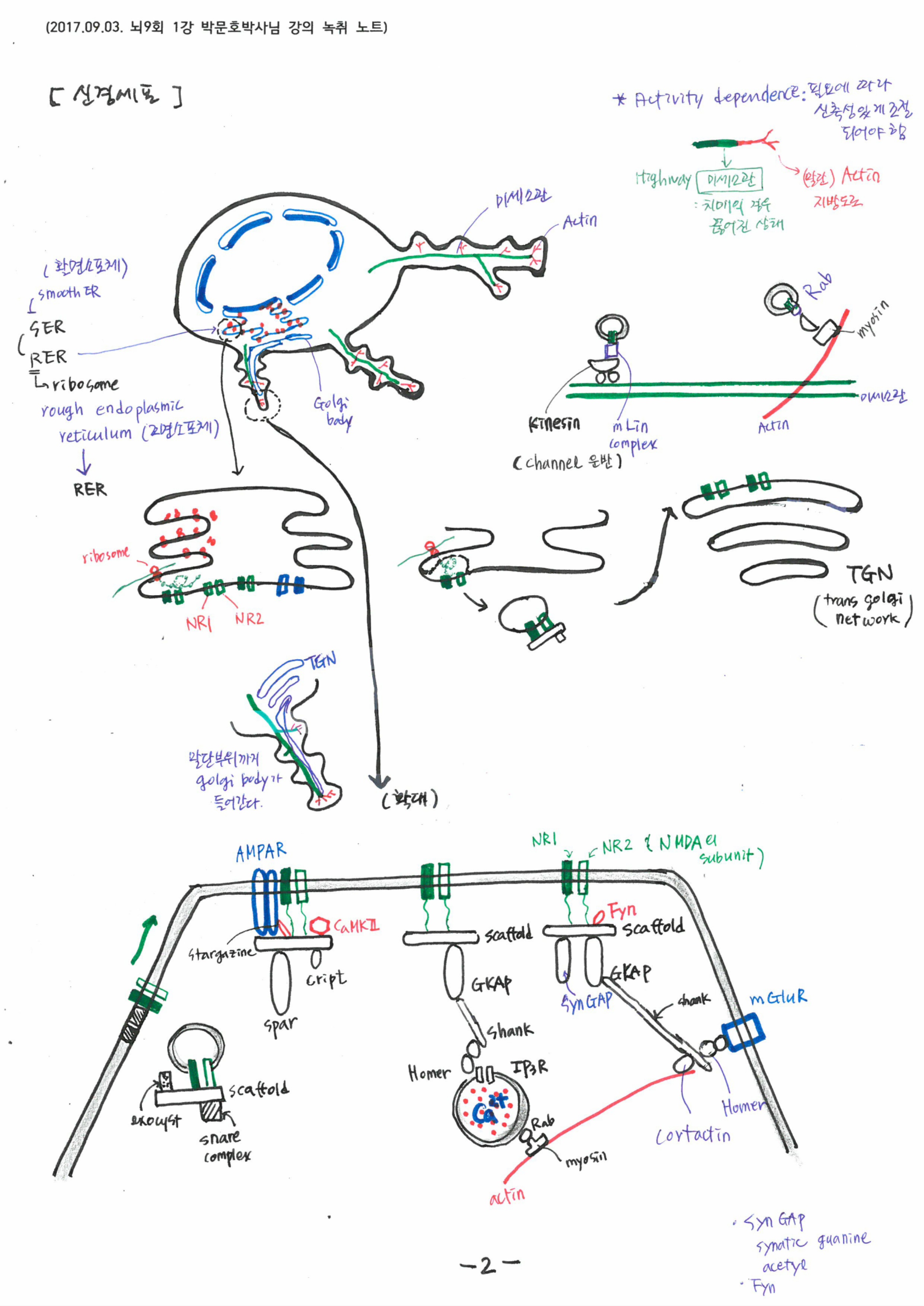
글로벌 actin등의 단백질을 벽돌처럼 사용하여 골격구조를 만듭니다. 신경돌기는 신경의 연결을 만드는 장치이고, 신경의 연결은 기억을 만듭니다. 세포 골격이 있어야 신경세포는 작동합니다. 이것을 가능하게 하는 모든 것이 세포의 단백질입니다.
신경단백질 또한 이동하기 위해서는 골지기관을 통해 주머니에 담겨야 합니다. 신경전달물질이 담겨진 주머니는 움직이는 단백질 키네신에 의해 미세소관이라는 고속도로를 타고 이동합니다.
정리하면 이렇습니다.
신경세포는 전기적 신호를 만드는 장치이고, 전기적 신호는 이온에 의해 만들어진다.이온은 채널을 통해 세포로 이동하거나 퍼내어지게 되는데 이것은 이온 채널을 통해서다. 이온채널은 칼슘의 유입에 의해 만들어지는데 칼슘의 유입을 하게 만드는 것도 신경세포의 활성전위에 의한다. 칼슘에 의해 만들어지는 이온채널이 NMDA등의 이온채널이다. 능동적 자극은 이렇듯 신경세포를 바꾼다.
전기신호는 신경세포의 신경종말을 자극하여 신경전달물질을 뿜어 낸다. 이 신경전달물질 또한 TGN에 의해 소포체에 담겨지고, 미세소관을 따라 키네신이 소포체를 옮긴다. 모두 단백질의 작용이다. 신경전달물질에 의해 시냅스 후막의 이온 채널이 열리고 막전위가 발생한다. 이 때 후 시냅스 또한 신경전달물질을 받기 위한 구조물을 형성한다. 최근 연구자료에 따르면 시냅스의 갭조차 단백질 기둥에 의해 고정되어 있다. 시냅스의 사이가 떨어지지 않게 고정하는단백질이 있을 정도이다. 기억은 단백질 구조가 만든 현상이다. 만약 이 구조가 무너지면 기억이 무너진다.
이를 치매, 알츠하이머라고 한다. 기억의 뿌리를 찾아가면 결국 이 구조를 만난다. 기억이 실체 없는 허상이라고
하면 안된다. 분자 구조를 셀 수 있을 정도로 기억의 뿌리는 실체가 있다.
박사님의 강의의 핵심은 기억이 흐리멍텅하거나 흐릿하지 않다는 내용이었습니다. 정확한 실체가 있다는 부분에서 깊은 감동이 있었습니다. 치매 또한 기억의 어떤 모습을 비추는 모습이라고 느껴졌습니다. 분자에서 기억에 이르는 이야기가 생명 30억년을 관통하는 내용으로 이어지고, 137억년의 총체가 나라고 말하는 강의는 깊은 상념으로 이어집니다. 어느 것 하나 버릴게 없는 공부의 연결성에 경이로움을 표합니다.
역시, 역시 솔다님. ㅎㅎ
우리가 ‘학습’을 해야 하는 이유를 명확하게 알려주시는군요.
박사님의 같은 강의를 듣고도 이렇게 내것으로 만든 분량 차이가 엄청난 걸 보면,
역시 이전 기억이 있어야 하고,
그 기억을 만들기 위해 일단 ‘암기’하고 볼 일이예요.
흥미로운 세포의 현실을 인용합니다.
“Eros 단세포생물을 광란의 짝짓기를 유도하는 세균 단백질”
The choanoflagellate S. rosetta. Schematics of ‘slow-swimmer’ single cell, base angle θ, and rosette colony / @ ResearchGate
세계적인 과학 저널리스트 에드 용이 쓴 『내 속엔 미생물이 너무도 많아』를 읽은 독자들은 ‘살핑고이카 로제타’라는 단세포생물과 ‘비브리오 피셰리’라는 세균이 생각날 것이다. S. rosetta는 세균의 신호를 받아 집락을 형성하는 단세포생물이고, V. fischeri는 짧은꼬리오징어의 발광을 책임지는 세균이다. 그런데 이 두 생물을 둘러싼 놀라운 비밀이 새로 밝혀졌다. V. 피셰리가 분비하는 단백질이 S. 로제타로 하여금 광란의 짝짓기를 통해 유성생식을 하도록 만든다는 것이다. 이번 연구는 점점 더 늘어나고 있는 「계(界)를 넘나드는 신호전달」의 사례를 추가로 제시한 것으로 평가된다.
과학자들은 단세포생물을 위한 놀라운 성욕촉진제(aphrodisiac)를 발견했다. 그것은 세균이 분비하는 단백질이다. 세균이 진핵생물(균류, 식물, 동물을 포함하는 생물계)의 성행동을 제어하는 수단이 발견된 것은 이번이 처음이다.
여기서 말하는 단세포생물은 갓편모충(choanoflagellate)으로, 정자와 비슷하게 생겼으며, 현존하는 단세포생물 중에서 동물과 가장 가까운 친척이다. 생물학자들은 단세포생물이 초기 다세포동물로 진화한 과정을 이해하기 위해 갓편모충을 연구하고 있다.
갓편모충은 평상시에 무성생식(분열)을 하는 것으로 알려져 있으며, 지금까지 과학자들은 먹이를 주지 않음으로써 유성생식(짝짓기)을 하도록 유도할 수 있었다.
UC 버클리의 니콜 킹 박사(미생물학)가 이끄는 연구진은 특정 세균의 신호가 갓편모충류의 일종인 살핑고이카 로제타(Salpingoeca rosetta)의 세포분열을 유도하는 메커니즘을 연구하던 중, 뭔가 놀라운 현상을 발견했다. 해양세균인 비브리오 피셰리(Vibrio fischeri)를 배지에 첨가했더니, S. 로제타가 떼를 지어 광란의 짝짓기를 통해 유성생식을 하는 게 아닌가!
“그것은 전혀 뜻밖이었다. 솔직히 말해서, 우리는 V. 피셰리를 대조군으로 사용하고 있었다. 왜냐하면 우리는 그게 다세포성(multicellularity)을 유도하지 않는다는 사실을 알고 있었기 때문이다”라고 이번 연구의 공동저자인 하버드 의대의 존 클라디 박사(생화학)는 말했다. 이번 연구는 8월 31일 《Cell》에 발표되었다(참고 1).
사랑의 단백질 에로스(EroS)
추가실험 결과, V. 피셰리가 단백질을 분비하고, 이것이 S. 로제타로 하여금 무리를 짓도록 유도하는 것으로 밝혀졌다. 연구진은 그리스 신화에 나오는 사랑의 신(神)의 이름을 따서, 이 단백질에 에로스(EroS)라는 별명을 붙였다. S. 로제타는 최대 35마리가 그룹을 형성하여, 머리를 맞대고 융합했다. 그런 다음 DNA를 복제하여 재조합하고, 최종적으로 ‘유전적으로 독특한 자손’으로 분열했다.
【참고】 S. 로제타가 무성생식에서 유성생식으로 전환하는 과정
“세균이 진핵생물의 짝짓기를 유도하는 것을 본 건 생전 처음이다”라고 텍사스 대학교 사우스웨스턴 메디컬센터의 바네사 스페란디오 박사(미생물학)는 말했다. “세균은 우리가 아는 것보다 다세포동물의 행동에 많은 영향을 미친다. 새로운 신호전달경로가 발견되면, 다른 생물그룹에서도 이와 비슷한 발견이 줄을 이을 것으로 예상된다.”
“편모충이 세균에게 짝짓기를 의존한다니 참 신기하다. 후속연구에서는 편모충이 자신의 성행동까지도 촉발할 수 있는지, 만약 그럴 수 있다면 그 방법은 무엇인지 알고 싶다”라고 영국 케임브리지 대학교의 닉 브라운 박사(세포생물학)는 말했다.
연구진은 자신들이 관찰한 S. 로제타의 메커니즘이 야생에서 통상적으로 생식할 때도 작동될 수 있을 거라고 생각하고 있다. S. 로제타는 V. 피셰리와 마찬가지로 해안에 서식하므로, 세균이 분비한 성욕촉진제의 농도가 편모충의 무리 형성을 촉진할 수 있을 것이다. 그렇게 되면 두 개의 세포들이 융합하여 유성생식을 할 가능성이 높아진다.
이번 논문의 저자인 UC 버클리의 아리엘 워즈니카 박사는 이렇게 제안했다. “편모충은 V. 피셰리를 ‘환경조건이 유성생식을 요구하는지’ 여부를 판단하는 지표로 사용하도록 진화한 것으로 보인다.”
짝짓기의 역학
세균이 편모충의 짝짓기를 제어하는 이유는 아직 분명하지 않다. 그러나 연구진은 단백질이 짝짓기를 유도하는 메커니즘에 대해 몇 가지 이론을 갖고 있다. 클라디 박사는 이렇게 제안한다. “EroS는 S. 로제타의 세포외기질(extracellular matrix: 세포를 둘러싼 구조단백질의 집합체)에서 발견되는 화합물을 절단하는 효소다. EroS가 겨냥하는 화합물은 황산콘드로이틴(chondroitin sulfate)인데, 당단백질로 구성되어 있다. 따라서 V. 피셰리는 EroS를 분비하여 이 분자를 처리하게 할 가능성이 높다. 세포외기질을 분해하면 세포가 물리적으로 부드러워지므로, 두 마리의 편모충이 융합할 수 있다.”
킹 박사는 다른 이유를 찾고 있다. “황산콘드로이틴은 EroS에 의해 절단될 때만 활성화되는 신호전달분자”라는 것이 그녀의 생각이다.
이번 연구는 점점 더 늘어나고 있는 「계(界)를 넘나드는 신호전달(cross-kingdom signalling)」의 사례를 추가로 제시했다. 「계를 넘나드는 신호전달」이란 하나의 생물그룹이 보내는 신호를 다른 생물그룹이 접수하는 과정을 말한다. “화학적 생태계는 풍부하며, 앞으로도 발견될 것들이 많다”라고 하와이 대학교의 로시 알레가도 박사(미생물학)는 말했다. “무성생식을 하는 것으로 알려진 다른 미생물들도 적절한 상황에 노출된다면 유성생식을 시도할지도 모른다”라고 그는 덧붙였다.
※ 참고문헌
1. Woznica, A., Gerdt, J. P., Hulett, R. E., Clardy, J., King, N., “Mating in the closest living relatives of animals is induced by a bacterial chondroitinase”, Cell (2017); http://dx.doi.org/10.1016/j.cell.2017.08.005
※ 출처: Nature http://www.nature.com/news/bacterial-aphrodisiac-sends-single-celled-organism-into-mating-frenzy-1.22549
공부할 수 있게 도움주셔서 너무 감사합니다~~^♡^